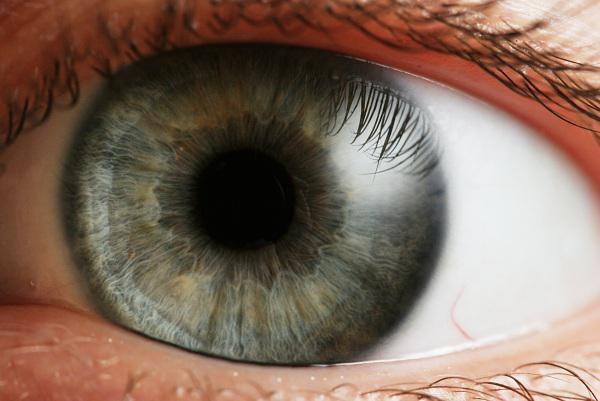
 Esses resultados podem potencialmente questionar dogmas da neurociência. (Foto: Wikimedia Commons).
Esses resultados podem potencialmente questionar dogmas da neurociência. (Foto: Wikimedia Commons).
Mais de 20 portadores de um tipo de cegueira causada por um defeito genético voltaram a enxergar graças a um tratamento desenvolvido por pesquisadores da University of Pennsylvania e do The Children’s Hospital of Philadelphia – ambos nos Estados Unidos. Um dos líderes do grupo é o brasileiro Valder Arruda, que apresentou resultados dos testes já realizados durante o evento "Advanced Topics in Genomics and Cell Biology", realizado entre os dias 4 e 6 de agosto na Universidade Estadual de Campinas (Unicamp) com apoio da FAPESP.
"Demonstramos a segurança e a eficácia do tratamento e estamos na fase de encontrar a dose capaz de ter efeito terapêutico em todos os pacientes. Acredito que essa possa ser a primeira terapia gênica aprovada para uso comercial pelo FDA [Food and Drug Administration, agência de vigilância sanitária americana]", disse Arruda, ex-professor da Unicamp e atualmente docente da University of Pennsylvania. Até chegar a essa fase, foram muitos anos de estudo e ensaios.
Em entrevista à Agência FAPESP, o pesquisador explicou que são conhecidos pelo menos 15 genes distintos que, mutados, resultam em cegueira congênita do tipo ACL. Todos eles causam uma degeneração progressiva da retina que tem início no nascimento. "Desde muito cedo, as crianças apresentam visão prejudicada e movimentos oculares incomuns. Geralmente, ficam cegas durante a adolescência", contou Arruda.
A terapia desenvolvida pelo grupo da University of Pennsylvania, que também conta com a liderança da oftalmologista Jean Bennett, visa tratar portadores de uma mutação no gene que codifica a proteína RPE65, envolvida no metabolismo da vitamina A – um nutriente essencial para a saúde dos tecidos oculares.
"Optamos por começar as pesquisas com o gene RPE65 porque existem alguns cachorros com a mesma mutação espontânea encontrada em humanos, o que facilita a realização dos testes pré-clínicos. Mas a tecnologia pode ser adaptada para outras formas de amaurose congênita e há grupos em vários países realizando pesquisas com esse objetivo. Claro que cada caso terá suas particularidades", disse Arruda.
O método consiste em inserir uma cópia sadia do gene RPE65 dentro de um vírus modificado. O vetor escolhido pelos pesquisadores foi o vírus adeno-associado (AAV, na sigla em inglês), uma espécie do gênero parvovírus que não causa doenças em humanos. "Retiramos o material genético do AAV e inserimos em seu lugar uma cópia do RPE65 e um promotor – molécula que vai mandar uma mensagem para ativar a expressão do gene. A ideia é aproveitar a capacidade natural do vírus de infectar as células humanas e depositar nelas seu material genético. Dessa forma, as células da retina passam a expressar a proteína RPE65 que antes era deficiente", explicou o pesquisador.
Em 2001, o grupo de Bennett publicou na revista Nature Genetics resultados promissores dos testes feitos em cães e, em seguida, com a parceria de Arruda, foram iniciados os primeiros ensaios em humanos.
"No ensaio clínico de fase 1, o objetivo era atestar a segurança do tratamento. Injetamos uma dose baixa do vetor viral em três adultos portadores da mutação. Normalmente, ensaios de fase 1 são feitos apenas em pacientes sadios, mas no caso da terapia gênica é diferente", explicou Arruda. Os primeiros exames feitos após o tratamento revelaram que a pupila dos voluntários, que antes não reagia à variação de luminosidade, passou a responder quase da mesma forma que a de uma pessoa com visão normal.
"Três semanas após a aplicação do vetor viral, uma das pacientes disse que estava conseguindo ver o contorno dos móveis de seu apartamento. A princípio, achei que fosse apenas efeito placebo, mas, poucas semanas depois, outro paciente relatou algo parecido", contou Arruda.
Testes posteriores feitos por uma equipe independente comprovaram que os três voluntários haviam recuperado a visão parcialmente, contrariando o conceito predominante na área de neurociência de que o cérebro de uma pessoa que passou muitos anos sem enxergar teria perdido para sempre a capacidade de interpretar os sinais captados pela retina.
"Essa primeira paciente italiana tinha 36 anos. Por meio de exames de ressonância magnética funcional, mostramos que as áreas do córtex visual que estavam inativas antes do tratamento passaram a apresentar atividade 30 dias após a injeção do vetor viral. E essa atividade estava bem maior 90 dias depois. Esses resultados podem potencialmente questionar o grande dogma da neurociência", disse Arruda.
Os primeiros ensaios feitos com 12 pacientes, entre ele um menino de 8 anos, foram divulgados em 2009 na revista The Lancet e mostraram que a eficácia do tratamento estava diretamente relacionada com seu início precoce. "Normalmente, são permitidos apenas maiores de 18 anos nos ensaios de fase 1. Mas, como se trata de uma doença degenerativa, pode não restar nenhum tecido retiniano para ser restaurado se demorarmos muito para começar o tratamento. Por conta disso, tivemos autorização para incluir crianças. Agora, estamos iniciando os ensaios de fase 3 e baixamos a idade mínima para 4 anos", contou Arruda.
Até o momento, 24 pacientes de países como Itália, Holanda, Bélgica, Estados Unidos e Austrália já receberam a injeção intraocular com o vetor viral – primeiro em um olho e, posteriormente, no outro – e apresentaram melhora visual sem qualquer evidência de toxicidade ou reação imunológica.
"Temos uma menina de 9 anos que passou a brincar de esconde-esconde, um menino de 16 anos que conseguiu tirar carteira de motorista e muitos adultos que se tornaram independentes. Todos se sentem mais confiantes", comemorou Arruda. [Da Agência Fapesp]



